Class 10th Chemistry Chapter 4 Notes in Hindi
कार्बन तथा इसके यौगिक
सिद्धांत :- सर्वप्रथम बर्जीलियस ने 1815 ई०
में जीवन शक्ति का सिद्धांत दिया,जिसके अनुसार सजीव पदार्थों में कार्बनिक
यौगिकों का निर्माण एक अदृश्य जीवन शक्ति द्वारा होता है।
लेकिन इस धारणा का अंत हुआ,जब
वोहलर ने प्रयोगशाला में यूरिया का संश्लेषण अमोनिया सायनेट को गर्म करके किया।
बाद में,कोल्बे ने एसिटिक अम्ल का तथा बर्थेलो ने मेथेन
का संश्लेषण किया।
➤ अबतक 10 लाख से ऊपर कार्बनिक यौगिक प्रयोगशाला में
बनाए जा चुके है।
➨लभ्वाजे ने प्रयोग द्वारा यह दिखाएँ की
कार्बनिक यौगिक प्रायः कार्बन,हाइड्रोजन,ऑक्सीजन,नाइट्रोजन,हैलोजन,फास्फोरस,गंधक और कुछ धातुओं के संयोग से बने होते है।
अतः कार्बनिक रसायन वस्तुतः
हाइड्रोकार्बन और उनके व्युत्पनों का रसायन है।
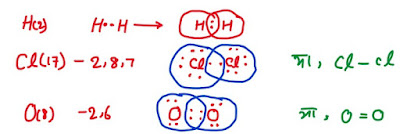
*रासायनिक बंधन - सहसंयोजन व
इलेक्ट्रॉन का साझा
⇒ जब दो परमाणु अपने बाह्यतम कक्षा के इलेक्ट्रॉनों का आपस में साझा करके संयोग करते है,तब उनके बीच स्थित बंधन को सहसंयोजन बंधन कहते है। तथा इस प्रकार से निर्मित यौगिक सहसंयोजक यौगिक कहलाते है।
➤जब दो परमाणु दो-दो इलेक्ट्रॉनों का साझा करते है तब दो सहसंयोजक बंधन बनते है,जिसे द्वि बंधन कहते है।
➤जब परमाणु तीन-तीन इलेक्ट्रॉनों का साझा करते है तब तीन सहसंयोजक बंधन बनते है,जिसे त्रिबंधन कहते है।
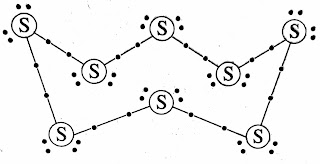
➤गंधक का अणुसूत्र S8 होता है तथा गंधक के आठो परमाणु जुड़कर ताज जैसा वक्र रिंग का निर्माण करता है।
*कार्बन के अपरूप (Allotrpes Of Carbon)
⇒ प्रकृति में कार्बन कई रूपों में पाया जाता है।
हिरा तथा ग्रेफाइट कार्बन की अपररूपी अवस्थाएँ है,जिनके कार्बन परमाणुओं की व्यवस्था में
भिन्नता होती है।
➤हिरा में कार्बन परमाणु त्रिविमीय
संरचना के रूप में सजे होते है। जिनमे प्रत्येक कार्बन चार अन्य कार्बन परमाणुओं
से सहसंयोजी बंधन द्वारा जुड़े होते है,जिससे हिरा कठोर हो जाता है।
➤ग्रैफाइट में प्रत्येक कार्बन परमाणु
तीन अन्य कार्बन परमाणु से एक तल में सहसंयोजी बंधन द्वारा जुड़कर षटकोणीय वलय
बनाता है जो परतों में व्यवस्थित होती है। इसी कारण ग्रैफाइट मुलायम तथा चिकना
होता है।
*कार्बनिक यौगिकों के सूत्र (Formula Of
Organic Compounds)
⇒कार्बनिक
यौगिकों के सूत्र तीन प्रकार से व्यक्त किए जाते है।
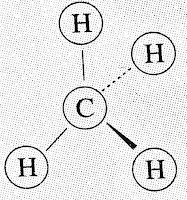
1. लूइस इलेक्ट्रॉन बिंदु संरचना (Lewis Electron Dot
Structure)
2. संरचना सूत्र (Structural Formula)
3. त्रिविमीय सूत्र (Three Dimensional Formula)
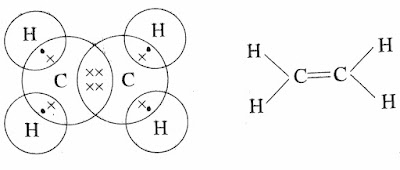
1. लूइस इलेक्ट्रॉन बिंदु संरचना
⇒यह
संरचना प्रत्येक परमाणु से जुड़े परमाणुओं की तथा संयोजन इलेक्ट्रॉन की व्यवस्था को
दर्शाता है।
जैसे :- एक बंधन युक्त कार्बन यौगिक,
इस प्रकार से कार्बन के परमाणु आपस में संयोग करके श्रृंखला बनाने की प्रवृति रखते है। कार्बन में उपस्थित इस गुण को कार्बन का श्रृंखलन गुण कहते है।
2. संरचना सूत्र
⇒संरचना सूत्र में दो परमाणुओं के बीच के बंधन इलेक्ट्रॉन को एक रेखा (一)(Bond) के द्वारा दर्शाया जाता है,जिसे एकल बंधन कहा जाता है।
3. त्रिविमीय सूत्र
⇒संरचना
सूत्र को त्रिविमीय आकृति में भी निर्देशित किया जाता है।
जैसे :-
*कार्बनिक यौगिकों का वर्गीकरण (Classifiion Of
Organic Compounds)
⇒कार्बनिक
यौगिकों की कुल संख्या अनगिनत होने के कारण कार्बनिक यौगिकों को कई वर्गों में
विभाजित किया जाता है।
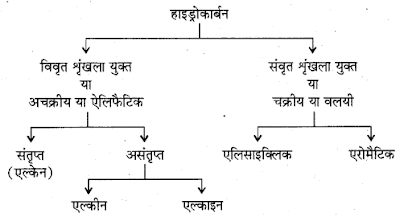
➤सबसे साधारण कार्बनिक यौगिक हाइड्रोकार्बन कहलाते है,जो कार्बन तथा हाइड्रोजन के संयोग से बनते है।
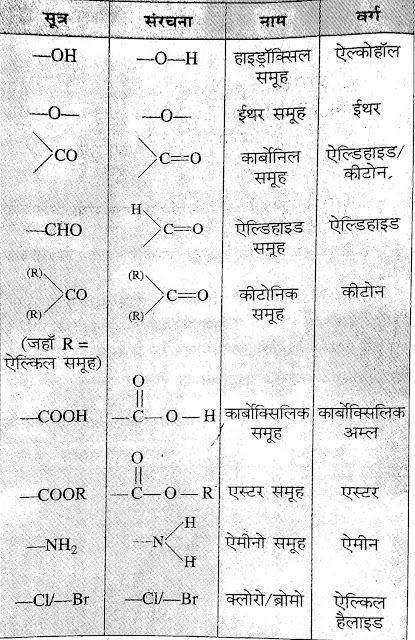
*क्रियाशील मूलक (Functional
Group)
⇒किसी कार्बनिक यौगिक में उपस्थित वह समूह जिस पर यौगिक का रासायनिक गुण निर्भर करता है। उस यौगिक का क्रियाशील समूह कहलाता है।
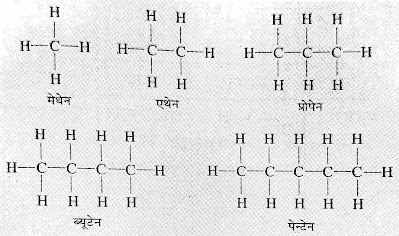
*समजातीय श्रेणी (Homologous Series) :-किन्ही
दो क्रमागत यौगिकों के अनुसुत्रों में 一CH2一
का अंतर होता है। इस श्रेणी के सभी
यौगिक में एक ही क्रियाशील मूलक उपस्थित रहती है।
जैसे :- ऐल्कोहॉल की समजातीय श्रेणी
मेथेनॉल CH3OH
एथेनॉल C2H5OH
प्रोपेनॉल C3H7OH
ब्यूटेनॉल C4H9OH
पेन्टेनॉल C5H11OH
*कार्बनिक
यौगिकों के नाम - IUPAC नामकरण (Naming Of
Organic Compounds – IUPAC Nomenclature)*
➤कार्बनिक यौगिकों के नामकरण की मुख्यतः
दो विधियाँ है।
1. साधारण प्रणाली (Common System) :-प्रारंभ
में कार्बनिक यौगिक के नाम उनकी प्राप्ति के स्रोत के आधार पर रखे गए।
जैसे :-फॉर्मिक अम्ल को सर्वप्रथम लाल
चींटी से प्राप्त किया गया था। लैटिन में लाल चींटी को फॉर्मिक्स कहते है।
IUPAC :-International Union Of Pure And Applied Chemistry
2. IUPAC प्रणाली :- एल्केन - IUPAC
प्रणाली में सभी कार्बनिक यौगिकों को
हाइड्रोकार्बन का व्युत्पन माना जाता है तथा उनके संगत के हाइड्रोकार्बन के नाम पर
ही आधारित होते है।
➤संतृप्त हाइड्रोकार्बन के नामाकरण में
ग्रीक संख्याओं के नाम के अंत में 'एन (ane)'
लगाया जाता है।
जैसे:-पेन्टा + एन → पेन्टेन
*ऐल्किल समूह :-एल्केन के अणु से हाइड्रोजन परमाणु को हटाने के फलस्वरूप प्राप्त समूह को एल्किल समूह (R) कहते है।
➤एल्किल समूह का सामान्य सूत्र CnH2n+1 होती है।
➤कुछ संतृप्त हाइड्रोकार्बन ऐसे भी होते
है जिनके कार्बन परमाणुओं से पाशर्व श्रृंखला जुड़ी होती है।
जैसे :-
*असंतृप्त हाइड्रोकार्बन
1. ऐल्कीन या ओलिफ़िन (Alkenes Or Olefins)
➤इसमें कार्बन के बिच द्विबंध होता है।
➤IUPAC प्रणाली के अनुसार नामाकरण में ऐल्केन के नाम
से एन (ane) हटाकर उसकी जगह पर ईन (ene) अनुलग्न
जोड़ दिया जाता है।
जैसे :-ऐल्क + ईन → ऐल्किन
➤एल्कीन का सामान्य सूत्र CnH2n होता
है।
2. ऐल्काइन या एसिटिलीन
➤ऐल्काइन में कार्बन-कार्बन त्रिबंध
होता है।
➤IUPAC प्रणाली के अनुसार नामकरण में एल्केन के नाम से
एन (ane) हटाकर उसकी जगह पर आइन (yne) अनुलग्न
जोड़ा जाता है।
जैसे :-ऐल्क + आइन → ऐल्काइन
➤ऐल्काइन का सामान्य सूत्र CnH2n-2 होता
है।
3.
ऐरोमैटिक यौगिक :- बेंजीन के सदृश्य यौगिकों को ऐरोमैटिक यौगिक
कहा जाता है।
जैसे :-बेंजीन अणु में छः कार्बन परमाणुओं की एक चक्रीय संरचना होती है जिसमें एकांतर क्रम (Alternate) से एकल बंध तथा द्विबंध होते है। कार्बन का चौथा बंध हाइड्रोजन से जुड़ा होता है।
4. ऐल्कोहॉल :- साधारण प्रणाली के अनुसार ऐल्कोहॉल के नामकरण
में ऐल्कोहॉल में उपस्थित ऐल्किल समूह के नाम में ऐल्कोहॉल शब्द जोड़ दिए जाते है।
जैसे :-
IUPAC प्रणाली के अनुसार ऐल्कोहॉल का नामकरण ऐल्कोहॉल के अनुरूपी ऐल्केन के नाम -ऑल (-ol) जोड़ा जाता है।
➤एल्केनॉल का सामान्य सूत्र CnH2n+1 OH होता है।
5. ईथर :- ईथर का नाम ऑक्सीजन से जुड़े ऐल्किल समूहों में
ईथर शब्द जोड़कर किया जाता है।
जैसे :-
6. ऐल्डीहाइड :- IUPAC प्रणाली के अनुसार ऐल्डीहाइड के नामकरण में
संगत एल्केन के नाम में -अल (-al) जोड़ दिया जाता है।
जैसे :-
➤ऐल्डीहाइड का सामान्य सूत्र CnH2n+1CHO
होता है।
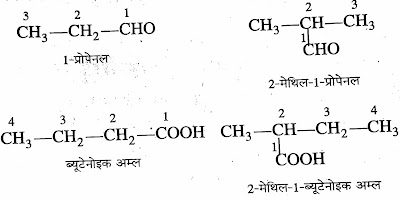
7. कार्बोक्सिलिक अम्ल :- IUPAC प्रणाली के अनुसार नामकरण में संगत एल्केन के
नाम में -ओइक अम्ल जोड़ दिया जाता है।
जैसे :-ऐल्केन + ओइक अम्ल ⇢ ऐल्केनोइक
अम्ल
➤इसमें क्रियाशील मूलक (-COOH) से
गिनना शुरू करते है।
➤कार्बोक्सिलिक अम्ल का सामान्य सूत्र CnH2n+1COOH होता है।
8. कीटोन :- IUPAC प्रणाली के अनुसार नामकरण में संगत ऐल्केन के
नाम में -ओन (-one) जोड़ा जाता है।
जैसे :-ऐल्केन + ओन ⇢ ऐल्केनोन
➤इसमें क्रियाशील मूलक (>C=O ) से
गिनना शुरू किया जाता है।
*समावयवी (Isomers):- वे कार्बनिक यौगिक जिनके अणुसूत्र समान होते है,लेकिन
भौतिक और रासायनिक गुण भिन्न-भिन्न होते है,
समावयवी कहलाते है। और ऐसी घटना
समावयवता कहलाती है।
जैसे :-
➨समावयवता कई प्रकार के होते है।
1. संरचनात्मक समावयवता (Structul Isomerism)
2. त्रिविम समावयवता (Stereoisomerism)
1. संरचनात्मक समावयवता :- कार्बनिक
यौगिकों के अणु में उपस्थित परमाणुओं एवं समूहों के विभिन्न प्रकार से जुड़े होने
के कारण जो समावयवता होती है,उसे संरचनात्मक समावयवता कहते है।
या,
वह समावयवता है जिसमें दो या दो से अधिक अणुओं, का अणुसूत्र तो समान होता है किन्तु उनके परमाणु आपस में अलग-अलग क्रम में आबन्धित होते हैं संरचनात्मक समावयवता कहलाते है।
➠संरचनात्मक
समावयवता निम्नलिखित प्रकार के होते है।
i. श्रृंखला समावयवता (Chain Isomerism):- कार्बन
की श्रृंखला में भिन्नता के कारण उत्पन्न होनेवाली समावयवता को श्रृंखला समावयवता
कहते है।
जैसे :-
ii. स्थान समावयवता (Position Isomerism):- क्रियाशील
समूह के स्थान में भिन्नता के कारण उत्पन्न होनेवाली समावयवता को स्थान समावयवता
कहते है।
जैसे :-
iii. क्रियाशील समावयवता (Functional Isomerism):- जब
दो या दो से अधिक यौगिकों के अणुसूत्र एक ही हो,लेकिन उनमें उपस्थित क्रियाशील समूह
भिन्न-भिन्न हो तो इस घटना को क्रियाशील समावयवता कहते है।
जैसे :-
2. त्रिविम समावयवता:- त्रिविम समवयवीयों का संरचना सूत्र समान होता
है,लेकिन
परमाणुओं एवं समूहों की स्थानिक व्यवस्थाय विन्यास भिन्न होते है।
➠त्रिविम
समावयवता दो प्रकार के होते है।
i. ज्यामितिक समावयवता (Geometrical Isomerism):- यह
समावयवता,वैसे ऐल्कीनों या उनके व्युत्पन्नो द्वारा
प्रदर्शित होती है,जिनके द्विबंध से जुड़े प्रत्येक कार्बन के साथ
दो भिन्न-भिन्न समूह जुड़े हो।
जैसे :-
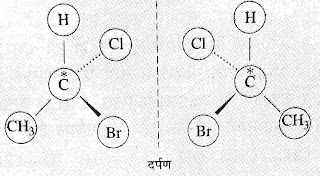
ii. प्रकाशिक समावयवता (Optical Isomerism):- वे
कार्बनिक यौगिक जिनके भौतिक व रासायनिक गुण समान होते हैं परन्तु उनका व्यवहार
समतल ध्रुवित प्रकाश के प्रति व्यवहार भिन्न - भिन्न होता है , एक
दूसरे के प्रकाशीय समावयवी कहलाते हैं और इस घटना को प्रकाशिक समावयवता कहते हैं ।
➤दोनों समावयवी एक-दूसरे के दर्पण
प्रतिबिम्ब होते है।
जैसे :-
*हाइड्रोकार्बन (Hydrocarbon)
⇒हाइड्रोकार्बन
को पेट्रोलियम से तथा हवा की अनुपस्थिति में कोयले को गर्म करके प्राप्त किया जाता
है।
➤हाइड्रोकार्बन के भौतिक गुणों में
बदलाव प्रत्येक श्रेणी में उपस्थित छोटे सरलतम यौगिकों से बड़े यौगिकों तक नियमित
रूप से होता है।
जैसे :-मेथेन ,एथेन
,प्रोपेन
और ब्यूटेन गैस है ,अगले तेरह ऐल्केन (C5 一 C17) द्रव
है और C18 और इससे ऊपर के ऐल्केन ठोस है।
➤ संतृप्त
हाइड्रोकार्बन के अणु अध्रुवीय होते है। अतः जल में अघुलनशील होते है।
* ऐल्केन (Alkane):-
ऐल्केन काफी स्थाई और अक्रिय यौगिक होते है। इनकी कुछ अभिक्रियाओं में दहन
(ऑक्सीकरण) तथा हैलोजनीकरण प्रमुख है।
*दहन (Combustion):- संतृप्त
हाइड्रोकार्बन वायु या ऑक्सीजन की उपस्थिति में नीले लौ के साथ जलकर कार्बन
डाइऑक्साइड और जल बनाते है।
जैसे :-
·
LPG
-प्रोपेन ,ब्यूटेन तथा आइसोब्यूटेन
·
पेट्रोल – C6 – C8 के संतृप्त हाइड्रोकार्बन
·
किरोसिन – C11 – C15 के संतृप्त हाइड्रोकार्बन
· डीजल – C15 – C18 के संतृप्त हाइड्रोकार्बन
*जीवाश्म ईंधन (Fossil Fuels)
⇒पृथ्वी
के अंदर लाखों वर्ष तक मृत पेड़-पौधों और जानवरों का मिट्टी,बालू
एवं चट्टानों की परतों के बीच दबे रहने के फलस्वरूप जो पदार्थ बनते है ,उसे
जीवाश्म ईंधन कहते है।
➤कोयला और पेट्रोलियम जीवाश्म ईंधन है।
➤बड़े आकारवाले पेड़-पौधों से कोयला बनता
है।
➤छोटे-छोटे पौधों से पेट्रोलियम का
निर्माण होता है।
*कोयले का निर्माण
⇒करोड़ों
साल पहले पृथ्वी पर होने वाली प्राकृतिक आपदाएं जैसे भूकंप, बाढ़, ज्वालामुखी
का निकलना, आकाश में बिजली का गिरना आदि घटनाओं के कारण
पृथ्वी पर उपस्थित पेड़ पौधों जमीन के अंदर दब गए और ऑक्सीजन के अनुपस्थिति के
कारण कोयले में रूपांतरण हो गए।
*पेट्रोलियम का निर्माण
⇒पेट्रोलियम
का निर्माण समुद्र में रहने वाले जीवों के संपीड़न से हुआ है। जब ये जिव मृत हुए
तो इनका शरीर समुद्र के निचे की सतह पर जम गए और धीरे-धीरे रेत एवं मिट्टी की तहों
द्वारा ढक गए। लाखों वर्ष में,वायु की अनुपस्थिति ,उच्च
ताप और उच्च दाब के कारण मृत जिव पेट्रोलियम में परिवर्तित हो गए।
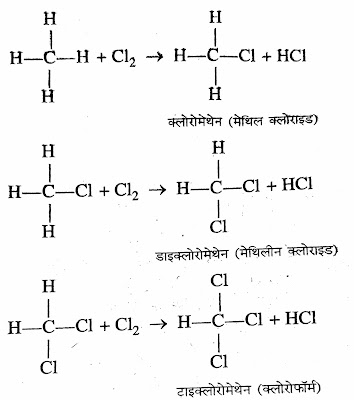
*हैलोजनीकरण (Halogenation):- विसरित सूर्य के प्रकाश की उपस्थिति में ऐल्केन की अभिक्रिया क्लोरीन के साथ होने पर ऐल्केन के सभी हाइड्रोजन परमाणु बारी-बारी से क्लोरीन परमाणु द्वारा प्रतिस्थापित हो जाते है।
➤इस अभिक्रिया को प्रतिस्थापन अभिक्रिया
कहते है।
*ऐरोमैटिक हाइड्रोकार्बन:- बेंजीन एक असंतृप्त यौगिक है। एल्कीन तथा
ऐल्काईन के गुणों से भिन्न बेंजीन मुख्य रूप से प्रतिस्थापन अभिक्रिया देता है।
➤सांद्र सल्फ्यूरिक अम्ल की उपस्थिति
में बेंजीन नाइट्रिक अम्ल से अभिक्रिया कर नाइट्रोबेंजीन बनाता है।
जैसे :-
*ऐल्कोहॉल:- ऐल्किल हैलाइड को जलीय सोडियम हाइड्राऑक्साइड के साथ गर्म करने पर ऐल्कोहॉल प्राप्त होता है।
➤व्यपारिक विधि में एथेनॉल(ऐल्कोहॉल) को
चीनी या स्टार्च के किण्वन द्वारा प्राप्त किया जाता है।
➤कार्बन मोनोऑक्साइड के अवकरण से
मेथेनॉल प्राप्त होता है।
➤कमरे के तापक्रम पर मेथेनॉल,एथेनॉल
तथा प्रोपेनॉल द्रव है।
➤एथेनॉल को ऐल्कोहॉल के नाम से भी जाना जाता है,जिसका उपयोग शराब के रूप में किया जाता है।
*ऐल्कोहॉल की अभिक्रिया
1. सोडियम से अभिक्रिया:- एथेनॉल सोडियम से अभिक्रिया कर सोडियम
एथॉक्साइड तथा हाइड्रोजन गैस देता है।
जैसे :-
2. सांद्र H2SO4 से अभिक्रिया:- एथेनॉल की अधिकता में यदि सांद्र H2SO4 के साथ 140C
पर गर्म किया जाये टी डाइएथिल ईथर बनता
है।
➤ यह अभिरकिया दो चरणों में होती है।
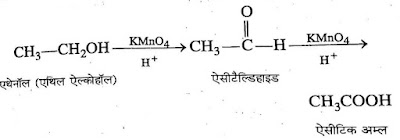
3. ऑक्सीकरण:- एथेनॉल अम्लीय KMnO4 से ऑक्सीकृत होकर एसीटैल्डिहाइड देता है। ये पुनः ऑक्सीकृत होकर एसिटिक अम्ल देता है।
*एथेनॉल ईंधन के रूप में,
⇒एथेनॉल
(ऐल्कोहॉल) ईंधन के रूप में भी उपयोगी है ,कुछ देशों में ऐल्कोहॉल(20%) को
पेट्रोल(80%) के साथ मिश्रित करके ईंधन के रूप में व्यवहार
किया जाता है।
➤शक्ति के उत्पादन के लिए प्रयोग में लाये जानेवाले ऐल्कोहॉल को पावर ऐल्कोहॉल कहते है।
*मेथेनॉल का उन्मादक प्रभाव
⇒ मेथेनॉल
का मानव शरीर पर उन्मादक प्रभाव पड़ता है तथा यह अत्यंत विषैला है। मेथेनॉल लिवर
में ऑक्सीकृत होकर मेथेनल में परिणत हो जाता है जो हमारी कोशिकाओं के साथ तेजी से
अभिक्रिया कर प्रोटोप्लाज्म को अंडे के ऑमलेट की तरह जमा देता है।
➤मेथेनॉल नेत्र सबंधी शिराओं को
प्रभावित कर अंधापन उत्पन्न करता है।
*कार्बोक्सिलिक अम्ल:- प्राइमरी ऐल्कोहॉल के ऑक्सीकरण से कार्बोक्सिलिक अम्ल बनाया जाता है।
➤एथेनोइक अम्ल को साधारण नाम एसिटिक
अम्ल है।
➤6-8% तनु एसिटिक अम्ल को सिरका कहते है।जिसका उपयोग अचार बनाने में रक्षक के रूप में होता है।
*एथेनोइक अम्ल की अभिक्रियाएँ
1. क्षार के साथ अभिक्रिया:- एथेनोइक अम्ल NaOH के साथ अभिक्रिया कर सोडियम एथेनोएट (सोडियम एसिटेट) तथा जल बनाता है।
2. सोडियम बाईकार्बोनेट और सोडियम कार्बोनेट के साथ अभिक्रिया:- एथेनोइक अम्ल सोडियम बाईकार्बोनेट और सोडियम कार्बोनेट के साथ अभिक्रिया करके फदफदाहट के साथ CO2 गैस मुक्त करता है।
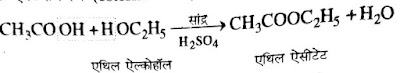
3. एस्टरीकरण:- सांद्र H2SO4 की उपस्थिति में एसिटिक अम्ल को एथिल ऐल्कोहॉल के साथ गर्म करने पर एथिल एसिटेट बनता है जो एक एस्टर श्रेणी का यौगिक है। एस्टर बनने की इस क्रिया को एस्टरीकरण कहते है।
➤एस्टर यौगिकों में फल जैसी मीठी गंध होती है।
*साबुन बनाने की विधि:- वनस्पति तेल या वसा को सोडियम हाइड्राऑक्साइड
विलयन के साथ गर्म करने से साबुन तथा ग्लिसरॉल बनता है।
➤उच्च सीधी श्रृंखला वाले कार्बोक्सिलिक
अम्लों (C12 -C20) लो वसा अम्ल कहा जाता है।
➤वनस्पति तेल और वसा,उच्च वसा अम्ल तथा ग्लिसरॉल से बने एस्टर होते है। प्रत्येक ग्लिसरॉल अणु तीन वसा अम्ल से जुड़े होते है।
*साबुनीकरण (Saponification):- वनस्पति
तेल एवं वसा का क्षार द्वारा जल अपघटन की क्रिया के फलस्वरूप साबुन तथा ग्लिसरॉल
का बनना साबुनीकरण कहलाता है।
*अपमार्जक (Dergent):- अपमार्जक उच्च ऐल्कोहॉल के हाइड्रोजन सल्फेट व्युत्पन के सोडियम लवण होते है।
Class 10th chemistry notes in hindi,10th chemistry notes in hindi ,10th chemistry notes chapter 4,chemistry notes in hindi,chemistry all chapter notes in hindi





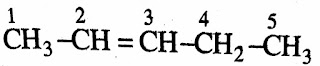
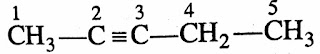

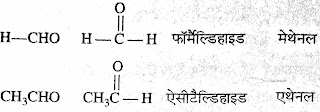
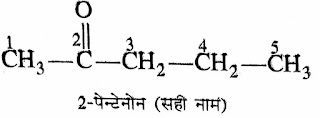
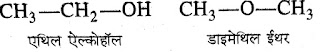

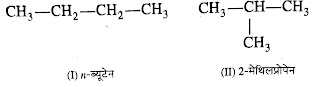
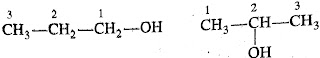
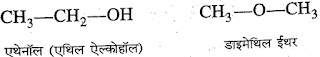


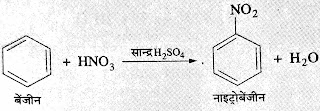
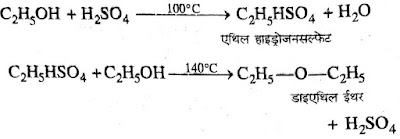

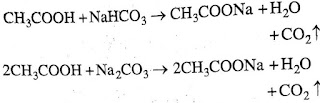






0 टिप्पणियाँ